Rychlost chemické reakce
13. 7. 2021 2021-08-04 14:00Rychlost chemické reakce
Rychlost chemické reakce
RYCHLOST CHEMICKÉ REAKCE
Průběh chemických reakcí ovlivňuje především druh látek.
Rychlost chemické reakce = zmenšení (úbytek) koncentrace výchozích látek nebo zvětšení
(přírůstek) koncentrace produktů za jednotku času.
K tomu, aby proběhla chemická reakce, musí být splněny některé podmínky:
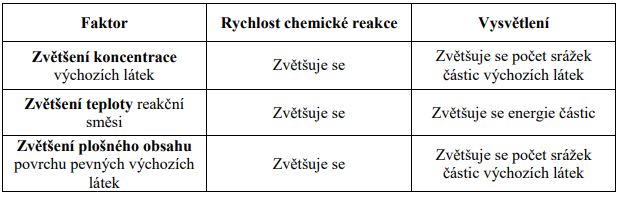
• Částice výchozích látek se musí srazit
• Energie částic při srážce musí být dostatečně veliká
• Složitější částice musí být při srážce vhodně orientovány
Na základě těchto podmínek můžeme vysvětlit některé faktory ovlivňující rychlost
chemických reakcí:
Katalyzátory = látky, které urychlují chemické reakce, ale po jejich ukončení zůstávají
nezměněny.
Např. katalyzátorem rozkladu peroxidu vodíku H2O2 je oxid manganičitý MnO2.
V chemické rovnici zapisujeme katalyzátory nad šipku:
MnO2
2 H2O2 → 2 H2O + O2
Katalyzátory jsou nezbytné v řadě chemických výrob např. při výrobě kyseliny sírové,
dusičné nebo plastických hmot.
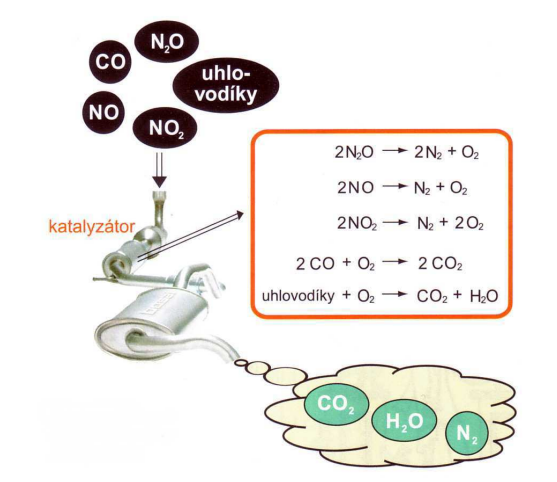
Velmi významné jsou automobilové katalyzátory, které snižují obsah škodlivin ve
výfukových plynech.
Inhibitory = chemické látky, které zpomalují průběh chemických reakcí.
Patří mezi ně i tzv. stabilizátory používané jako přídavné látky v potravinách.
Jsou to chemické látky, které zabraňují průběhu některých chemických reakcí.
Používají se jako přídavné látky v řadě potravin a nápojů (majonézy, kečupy, marmelády) a
pomáhají jejich vzhled, chuť a zabarvení.
Schéma činnosti automobilového katalyzátoru