Neutralizace
15. 7. 2021 2021-08-04 14:03Neutralizace
Neutralizace
NEUTRALIZACE
Neutralizace je reakce kyselin s hydroxidy, při které
vzniká voda a sůl:
KYSELINA + HYDROXID → VODA + SŮL
Podstatou neutralizace je reakce vodíkových kationtů s hydroxidovými anionty, při které
vzniká voda a uvolňuje se teplo:
Kyselé roztoky lze neutralizovat zásaditými roztoky a naopak.
Příklad neutralizace:
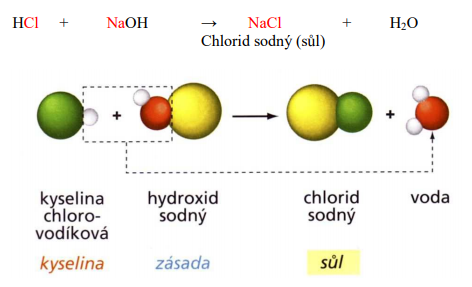
Využití neutralizace:
• Při výrobě mnoha látek např. solí
• Při úpravě odpadních vod
• V laboratořích
• Podstata PRVNÍ POMOCI při zasažení kyselinami či hydroxidy. Nejprve je
však nutné žíravinu zředit proudem vody a teprve pak použít předepsaný
prostředek k neutralizaci. V tomto případě nelze silnou kyselinu neutralizovat
silným hydroxidem a obráceně, protože by se poškození organismu zvětšilo.
K tomuto účelu se používají zředěné roztoky slabých kyselin (např. kyseliny
octové, citronové) a roztoky, které reagují slabě zásaditě (např. roztok
uhličitanu sodného – sody).
Příklady neutralizací:




