Hydroxidy
15. 7. 2021 2021-08-04 14:03Hydroxidy
Hydroxidy
HYDROXIDY
Hydroxidy jsou tříprvkové sloučeniny, které obsahují HYDROXIDOVÉ ANIONTY
OH- vázané na kationty kovu (případně na kation amonný NH4+).
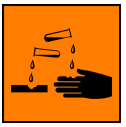
POZOR!! Hydroxidy a jejich roztoky jsou silné žíraviny!!
1. POMOC: Postižené místo omýváme proudem studené vody. Potom můžeme opláchnout
roztokem slabé kyseliny, např. octem a potom opět vodou.
Názvosloví:
Obecný vzorec: X (OH)n X = kov
n = má hodnotu oxidačního čísla daného kovu
Oxidační číslo hydroxidové skupiny je vždy – I: (OH)-I
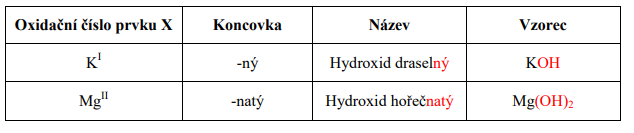
Název hydroxidu je dvouslovný:
1. Podstatné jméno = je vždy HYDROXID
2. Přídavné jméno = název prvku X + příslušná koncovka podle oxidačního čísla

Odvodit název hydroxidu ze vzorce je velmi jednoduché.
Počet (OH)-I skupin vázaných s atomem prvku X udává jeho oxidační číslo.
Názvy a vzorce některých hydroxidů:

Zástupci:
HYDROXID SODNÝ Na OH
HYDROXID DRASELNÝ KOH:
Vlastnosti:
• Bílé pevné látky (pecičky)
• Dobře rozpustné ve vodě (při rozpouštění je nutné směs míchat, neboť se uvolňuje
teplo
• Jejich roztoky (nazývané též LOUHY) jsou silné žíraviny!!
• Jsou hygroskopické, pohlcují vzdušnou vlhkost a CO2 (uchovávat v dobře těsnících
nádobách!!)
• Vyrábějí se elektrolýzou roztoků svých chloridů
• Ve vodném roztoku se štěpí na ionty – sodný kation Na+
a hydroxidový anion OH-:
NaOH → Na+ + OH-
Použití:
• Výroba mýdel, papíru, plastů
• Součást zubních past a pracích prášků
• Odstraňování starých nátěrů
• Čištění pivních a jiných lahví
• Látky často používané v chemických laboratořích

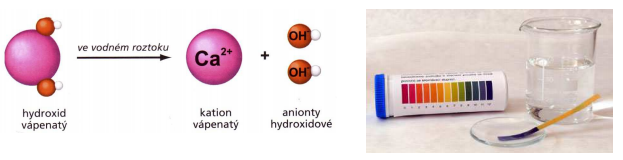
HYDROXID VÁPENATÝ Ca (OH)2 = hašené vápno:

Vlastnosti:
• Bílá pevná látka
• Jeho roztok je silná žíravina!! Ve vodě je méně rozpustný.
• Ve vodném roztoku se štěpí na ionty – vápenatý kation Ca2+ a hydroxidový anion OH-:
Ca (OH) → Ca2+ + 2 OH-
Výroba:
• Rozklad vápence (uhličitanu vápenatého CaCO3) za vysoké teploty:
CaCO3 → CaO + CO2
• Reakce oxidu vápenatého CaO (páleného vápna) s vodou:
CaO + H2O → Ca (OH)2
Použití:
• Ve stavebnictví jako tzv. hašené vápno (vápenný hydrát) k výrobě vápenné malty (ve
směsi s pískem a vodou)
• V zemědělství jako hnojivo pro kyselé půdy
• V cukrovarech při čištění cukerné šťávy
• Má dezinfekční účinky – bílení zdí zemědělských staveb, sklepů apod.
• S hydroxidem sodným tvoří směs nazývanou NATRONOVÉ VÁPNO, která se
používá např. v ponorkách nebo kosmických lodích k odstraňování vydechovaného
oxidu uhličitého CO2




