Galvanické články
15. 7. 2021 2021-08-04 14:05Galvanické články
Galvanické články
GALVANICKÉ ČLÁNKY
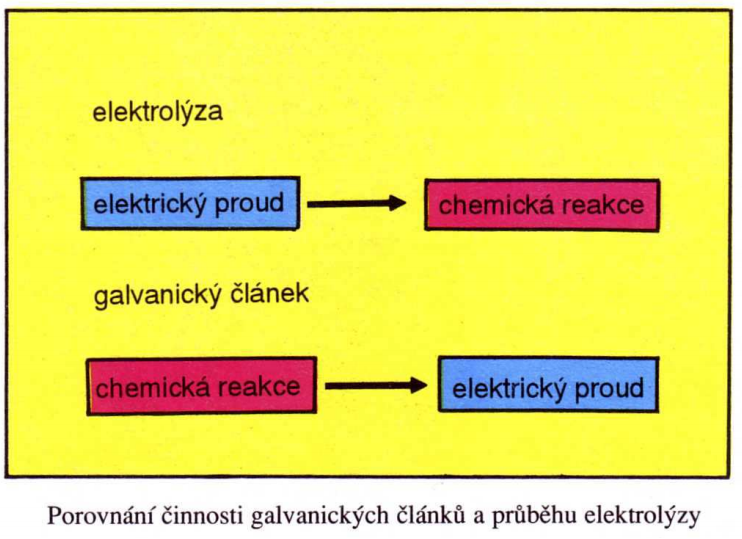
Poznali jste, že některé chemické reakce probíhají při „spotřebě“ elektrické energie. Může
tomu být i tak, že chemické reakce jsou zdrojem elektrické energie. Takovým zdrojem energie
mohou být galvanické články.
GALVANICKÝ ČLÁNEK je zařízení, které jako zdroj elektrické energie využívá
redoxní reakce.
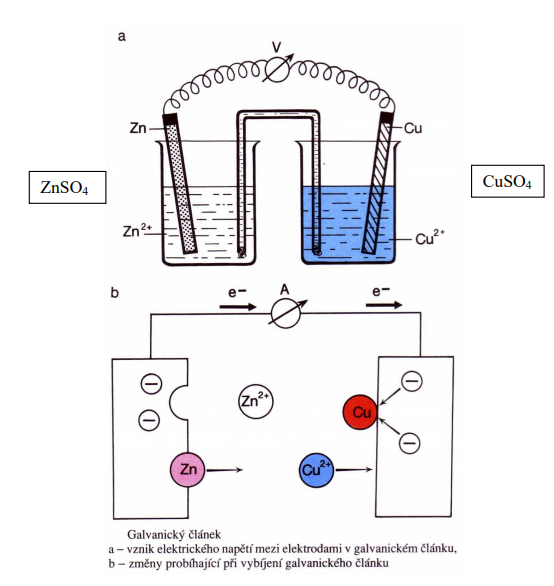
Příklad galvanického článku:
Vznik elektrického proudu (proudu elektronů) v pokusném galvanickém článku vysvětlují
rovnice:
• Kovový zinek se oxiduje, ztrácí elektrony a mění se na zinečnaté kationty:
• Měďnaté kationty Cu2+ přijímají elektrony a vzniká kovová měď:
Galvanické články jsou běžným zdrojem elektrické energie všude tam, kde není možné použít
elektrickou energii ze sítě.
Používají se v kapesních svítilnách, v tranzistorových rádiích a walkmanech, v digitálních
hodinkách, v moderních fotoaparátech.
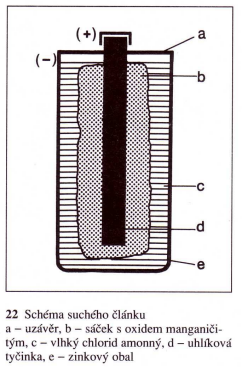
SUCHÝ ČLÁNEK je nejznámějším galvanickým článkem.
Záporný pól článku tvoří zinkový obal naplněný pastou, která obsahuje především chlorid
amonný.
Kladnou elektrodou je uhlíková tyčinka obalená oxidem manganičitým.
Galvanické články, o nichž jsme se zmínili, se dlouhodobým odběrem elektrické energie
vybíjejí a je nutné je nahradit jinými.
AKUMULÁTORY jsou galvanické články, které se dají po vybití znovu nabít a používat
k odběru elektrické energie vícekrát.
Příkladem je olovněný akumulátor používaný jako zdroj elektrického proudu v motorových
vozidlech.
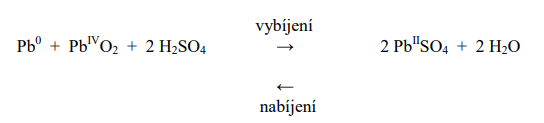
OLOVNĚNÝ AKUMULÁTOR se skládá z nádoby, v níž je roztok kyseliny sírové. V tomto
roztoku jsou střídavě ponořeny desky z olova a z olova pokrytého vrstvou oxidu olovičitého
PbO2.
Při odběru elektrického proudu (při vybíjení) atomy olova uvolňují elektrony a oxid olovičitý
je přijímá. Vzniká síran olovnatý PbSO4 a vodu.
Při nabíjení akumulátorů stejnosměrným elektrickým proudem probíhá děj opačný
(elektrolýza):