Periodická soustava prvků
14. 7. 2021 2022-10-01 14:29Periodická soustava prvků
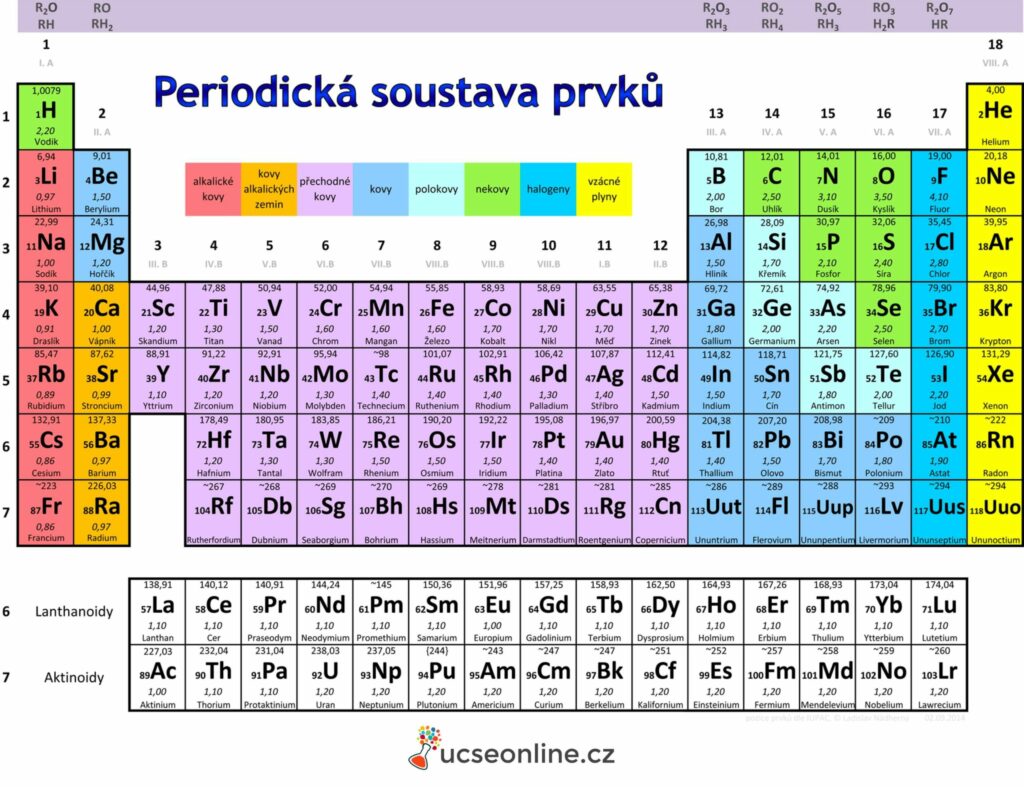
Periodická soustava prvků
- Historie vzniku, vysvětlení pojmu skupina a perioda, charakteristické názvy skupin. Chemické značky a názvy prvků. Rozdělení prvků. Periodický zákon a jeho vztah ke struktuře a vlastnostem prvků (oxidační čísla, poloměry atomů, elektronegativita, ionizační energie, redoxní a acidobazické vlastnosti). Chemické složení živých soustav.
- Určení oxidačních čísel a úprava chemické rovnice.
- – Periodická soustava prvků
- je uspořádáním všech chemických prvků v podobě tabulky podle jejich rostoucího protonového čísla a seskupené podle jejich cyklicky se opakujících podobných vlastností.
- chemický prvek: částice z atomů o stejném protonovém čísle
- periodický zákon: fyzikální a chemické vlastnosti prvků a jejich sloučenin se periodicky mění v závislosti na vzrůstajícím protonovém čísle > grafickým vyjádřením periodická tabulka prvků
- vlastnosti prvků závisí na protonovém čísle (z počtu protonů odvodím počet elektronů)
- vlastnosti prvků závisí na uspořádání elektronů v elektronovém obalu
Historie vzniku
- 1869: Dimitrij Ivanovič Mendělejev – periodický zákon
- seřazení prvků do tabulky dle atomové hmotnosti: Mendělejevova tabulka prvků
- 1913: Henry Moseley – seřazení prvků dle rostoucího protonového čísla
Skupina x perioda
- periody
- řady
- arabská číslice
- prvky uspořádány dle rostoucího protonového
- počet elektronových vrstev, poslední je valenční vrstva
- skupiny:
- sloupce
- římské číslice + písmena (I. – VIII. A/B)
- podobné chemické a fyzikální vlastnosti
- stejný počet valenčních elektronů
Charakteristické názvy skupin:
- I. A: alkalické kovy (x H)
- II. A: kovy alkalických zemin (x Be, Mg)
- III. A: triely
- IV. A: tetrely
- V. A: pentely
- VI. A: chalkogeny
- VII. A: halogeny
- VIII. A: vzácné plyny
- VIII. B: triáda železa (Fe, Co, Ni), lehké platinové kovy (Ru, Rh, Pd), těžké platinové kovy (Os, Ir, Pt)
Chemické značky a názvy
- značky odvozeny z latinských názvů
Rozdělení prvků
Kovovost
- kovy:
- menší počet elektronů ve valenční vrstvě, menší hodnota ionizační energie
- tažné, kujné, energetická a tepelná vodivost, kovový lesk
- polokovy:
- bor, křemík, tellur
- nekovy:
- větší počet elektronů ve valenční vrstvě, větší hodnota ionizační energie
- velká elektronová afinita, struktura valenčních orbitalů podobná nejbližšímu vzácnému plynu
Přechodnost
- nepřechodné prvky:
- s-prvky (I. A, II. A, Helium), p-prvky
- vnitřně přechodné prvky:
- f, d-prvky (lanthanoidy a aktinoidy)
- přechodné prvky:
- d-prvky
Skupenství:
- plynné – prvky v pravé horní části periodické tabulky (vzácné plyny, N, O, F, Cl)
- kapalné – pouze 2 v přírodě se vyskytující prvky – brom a rtuť
- pevné – většina prvků
Tvar orbitalů:
- s, p, d, f prvky
Chemických vlastností:
- skupiny prvků
Periodický zákon a jeho vztah ke struktuře a vlastnostem prvků (oxidační čísla, poloměry atomů, elektronegativita, ionizační energie, redoxní a acidobazické vlastnosti)
- periodický zákon: fyzikální a chemické vlastnosti prvků a jejich sloučenin se periodicky mění v závislosti na vzrůstajícím protonovém čísle > grafickým vyjádřením periodická tabulka prvků
oxidační čísla:
- zleva doprava roste oxidační číslo
- MAX: stejné jako číslo skupiny (I. – VII.)
- MIN: -IV (IV. A), -III. (V. A), -II. (VI. A), -I.(VII. A)
- prvky vlevo mají tendence vyskytovat se spíše v kladných oxidačních číslech, prvky napravo tvoří mnoho sloučenin se zápornými oxidačními čísly, ale i mnoho sloučenin s velkými kladnými oxidačními čísly (síra +VI apod.)
poloměry atomů:
- poloměry atomů zleva doprava klesají (velké vnitřní síly drží atom více pohromadě), ve skupině ze shora dolů narůstají (postupně přibývají elektronové obaly)
elektronegativita:
- míra schopnosti přitahovat elektrony spojené s jiným atomem
- v periodách roste zleva doprava, ve skupinách roste zdola nahoru (např. reaktivní řada halogenů: F, Cl, Br, I, fluor je nejreaktivnější)
ionizační energie:
- objem energie, který je potřeba dodat, aby atom odštěpil jeden elektron (vždy kladný)
- roste zleva doprava po periodě, ve skupinách roste zdola nahoru
redoxní a acidobazické vlastnosti:
- prvky nalevo mají tendence být redukčními činidly, prvky napravo oxidačními
- I. A II. A jsou silná redukční činidla (velmi nízká elektronegativita)
- d-prvky jsou slabá redukční činidla
- III. – VIII. A: oxidační účinky rostou zleva doprava a ve skupině směrem nahoru (čím výše a víc vpravo, tím silnější oxidační činidlo)
- kyselý charakter roste v periodě zleva doprava, ve skupině směrem nahoru
- I. a II. A oxidy a hydridy jsou zásadité, chloridy jsou neutrální
- d-prvky oxidy a hydridy jsou zásadité, některé amfoterní, chloridy reagují kysele
- III. – VIII. A oxidy, chloridy a většina hydridů má kyselý charakter (kromě NH3, CH4 a H2O)
Chemické složení živých soustav
Biogenní prvek
- Prvky, ze kterých se skládají živé organismy
- C, H, O, N, S, P
Biogenní látky
- Anorganické látky, ze kterých se skládají organické, jsou dále zpracovávány v potravním řetězci (viz metabolismus síry), mnohé jsou pro člověka stavebními látkami až po zpracování
- CO2 -zdroj uhlíku
- H2O
- NH3, N2, NO3-
- SO2, H2S
- H3PO4, fosforečnany
Složení živých systémů
- Anorganické látky:
- H2O
- ionty: K+, Na+, Mg2+, Ca2+, HPO42-, Cl-, SO42-, HCO3-
- Stopové prvky: ionty těžkých kovů…
- Organické látky malé a střední velikosti:
- Aminokyseliny, nukleotidy, mono a oligosacharidy, karboxylové kyseliny, aminy, močovina, lipidy
- Větší organické látky:
- Bílkoviny, nukleové kyseliny, polysacharidy (škrob, glykogen…)
Úprava rovnic a oxidační čísla
- oxidační čísla je možné určit podle sloučeniny a typických prvků
- úprava rovnice probíhá podle zákona zachování hmotnosti:
- na obou stranách rovnice musí být stejné atomy
- na obou stranách rovnice musí být těchto atomů stejný počet
- při úpravě složitějších redoxních rovnic:
- napíšeme oxidační čísla ke všem sloučeninám
- najdeme prvek, který se redukuje a prvek, který se oxiduje
- napíšeme oba dva prvky spolu se správnými stechiometrickými koeficienty pro jednu stranu a napíšeme, kolik elektronů jim přibude nebo ubude
- prohodíme počty elektronů mezi těmito dvěma prvky pomocí šipek
- počet elektronů reprezentuje počet atomů toho daného prvku na opačné straně rovnice
- vyčíslíme redukující se a oxidující se prvky na obou stranách rovnice
- vyčíslíme ostatní atomy
reklama